Home > 海外取材報告 > Dr. 林の米国取材:Society of Surgical Oncology , Cancer Symposium
Dr. 林の米国取材:Society of Surgical Oncology , Cancer Symposium
Society of Surgical Oncology, Cancer Symposium, Phoenix, Arizona "A Comprehensive Breast cancer Update for the Practicing Surgeon"
現地取材:林 直輝(聖路加国際病院/ブレストセンター乳腺外科)
2009年3月4日から8日にわたりArizona, Phoenixにて第62回Society of Surgical Oncology,Cancer Symposiumが行われました。今年から、会の初日に、『A Comprehensive Breast cancer Update for the Practicing Surgeon』と称された、乳腺外科医のためのワークショップが開催されるようになりました。診断から治療、臨床試験まで、最新の知見を非常にわかりやすくまとめられた本ワークショップの報告をいたします


中村清吾先生と Dr.Victor J. Zannis とともに 会場の様子
Genetic Pathology-Letting Go of the Microscope
Pat Whitworth, MD,Director, Nashville Breast Center, Clinical Associate Professor of Surgery, Vanderbilt University,Nashville, TN
Genomic Tumor Profiling
21世紀に入り、遺伝子レベルの技術はめまぐるしい進歩を遂げています。Genetic Tumor Profiling、腫瘍の遺伝子解析の目的は大きく、
- 病期と治療の両方を合わせた上での予後予測
- 個別化治療のための治療の効果予測
をすることにあります。
近年、再発予測、治療効果予測の手段としてAdjuvantOnline、OncotypeDxなどが利用可能になっています。現在行われているTAILORx試験は、リンパ節転移陰性のER陽性乳癌患者にまず、OncotypeDxを行い、再発リスク (low,intermediate,higk risk)ごとに異なる治療方法を行う試験が行われています。
OncotypeDXは、3つの試験の結果を合わせた447人、250遺伝子を解析し、再発に関連する21の遺伝子を解析することで、再発リスクのレベルにあわせ、3つのリスクグループに分け予測したものです。
NSABP B-14試験の結果を、OncotypeDXを用いて3つのリスクグループに分けて予後を検証した試験では、15年無再発率がLow risk群93%(n=338)と比較し、High risk群69%(n=181)と有意に差を認めました。また、同結果をNCCN分類と比較すると、NCCN分類でHigh Riskと示された668人中300人が、OncotypeDXではLowrisk群と分類されました。また、TAM投与の有効性をみると、 OncotypeDXでのlow,intermediate risk群には有意に有効であったことが示されました。
NSABP B-20試験では、リンパ節転移陰性ER陽性乳癌患者の術後療法として、TAM単独よりも、TAMおよび化学療法併用のほうが有用であったことを示しました。同対象患者の中で、OncotypeDXによるHigh Risk群では、TAM及び化学療法併用では10年で20%もの再発を減少させたことが示されました。これらにより、ASCO、NCCNの乳がん診療ガイドラインでは、術後療法の治療方針決定にOncotypeDXを用いることが推奨されるようになりました。また、他にも、予後、治療効果予測の手段として、70遺伝子解析を用いたMammaPrintや、76遺伝子解析を用いたRotterdamなども出てきておりますが、今後のさらなるデータの集積と実用化が待たれます。
Molecular Sentinel Node Analysis
現在、日本では保険適応が待たれるセンチネルリンパ節生検ですが、一般的に行われるHE染色、免疫組織学的染色によるセンチネルリンパ節の転移診断に加え、分子レベルでの診断技術が始まっています。GeneSearchTMはCytokeratin(CK19)とMammaglobin(MG)をPCR 解析で検出し診断するというものです。0.2mm-2.0mmのMicrometastasisの同定率は、通常の迅速病理診断での54.5%に比較し、 81.8%と非常に高い値を示しました。センチネルリンパ節だけでなく、リンパ節診断全般に用いることができること、診断の正確性、病理医の負担の減少などの点で非常に期待できる診断方法であります。
State of the Art Breast Imaging
Arthur G. Lerner, MD,Chairman of the Board of Directors, ASBS,Surgical Director, Dickstein Cancer Center,White Plains Hospital,White Plains, NY
フィルムマンモグラフィVsデジタルマンモグラフィ
近年の画像診断の進歩、乳癌の分野においても非常に進歩し、より正確な診断が適切な治療に結びつくようになっています。 1917年に初めてマンモグラフィが行われて以来、現在では検診に広く用いられています。近年、デジタルマンモグラフィが用いられるようになりました。デジタルの利点は、乳房の圧迫がより少なく済む、解像度がフィルムよりも高い、スクリーニングで取り直しのために呼び戻すことが減る、より高い癌の発見率が期待される、フィルムレスの時代に役に立つ、などです。Radiology誌の2001、2003年にそれぞれ、デジタルマンモグラフィは通常のフィルムマンモグラフィと比較し、癌の同定率に差がない、取り直しのための呼び戻しが減ったと報告されました。また、New England Journal of Medicine誌の2005年に報告されたAn ACRIN Trialでは、42760人のスクリーニングに、デジタルとフィルム両方を行ったところ同等であったこと、50歳以下、全閉経前女性、 DenseBreastの女性にはデジタルのほうがより正確であったことが示されました。現在では、更なるデジタルマンモグラフィの機器の進歩により、これらの報告よりも現在のほうがより良い結果を示せるだろうと考えられます。しかし、日本でも、機器の高額化が普及への壁になっています。
超音波
超音波は、診断、生検の補助手段、手術室での切除検体の断端評価などで有用です。マンモグラフィだけでは同定不可能な病変の検出能力もありますが、スクリーニングのための超音波の使用に関しては議論の多いところではあります。JAMA誌2008年に報告されたACRIN Trialでは、乳癌既往、家族性乳癌がある、などのハイリスクの女性のスクリーニングに対しては有用性が示されましたが、偽陽性が増え、結果的に余計な精査が増えたことも示されました。 また、近年3D、Color flow Doppler、Automated ultrasound、CTとの合成、エラストグラフィなど追加機能が開発されており、これらが近い将来、さらに診断に有用な手段として用いられる可能性があります。
Breast MRI
外科医は術前のいろいろなモダリティの中でMRIを選択するには、MRIの長所と、短所、適応を知っておく必要がある、というのが今回の主題目でありました。この背景には、翌日のDebate Sessionでも大きく話題となっていたように、米国ではMRIは非常に高額であることもあり、コストベネフィットの点でMRIをルーティンで用いることが困難なため、使うべきか否かの議論が多くなっているようです。 MRIは、反対側や、同側の病変を同定することが可能であり、切除範囲の決定に有用であることが長所であります。癌に対する感度90−97%、特異度 60−80%です。線維線種、乳頭腫、正常乳腺の一部、ホルモン剤の内服、閉経前女性の月経周期により強調され、偽陽性となることがあります。当然、検査のためランダム化臨床試験を組んでの高いエビデンスを作ることは困難ではありますが、そのため、米国でのルーティンの使用まではもう少し議論が続きそうです
PET
PETは、現在は転移診断などで多く用いられています。しかし、1cm未満の腫瘍や、高分化型の腫瘍では感度が低くなります。また、炎症、のう胞性病変、乳汁などが偽陽性を示します。術前化学療法の効果判定に用いる研究もおこなわれていますが、現在、実用されるほどのデータはありません。転移性乳癌患者に対しては、転移部位の同定に関しては、PET単独92%よりPET/CT96%と高い値を示していますがこれも40例の研究にすぎません。
PET Mammography(PEM)
PEMは18FDGの代謝を見るものです。PETより解像度が高く、ミリ単位の腫瘍が同定可能と多施設研究の結果が示されています。現在、実臨床への応用に当たり、MRIなどとの有用性の比較試験が行われています。
Breast-Specific Gamma Imaging
Future Technologies
さらに、マンモグラフィを3Dで構築する技術であるTomosynthesisや、Vascularityを見ることでより高い組織学的診断をする Optoacoustic Imagingなど、近い将来、実臨床でいかされるであろう新たなモダリティの開発が進んでいます。
50 Ways to Radiate the Breast
Rakesh R. Patel, MD,Director of Breast and Prostate Brachytherapy,Assistant Professor,Department of Human Oncology,University of Wisconsin School of Medicine and Public Health,Madison, WI
フィルムマンモグラフィVsデジタルマンモグラフィ現在の乳房部分切除後の術後照射は5〜6週間の全乳房照射です。EBCTTG(Lancet誌、2005年)における報告では、乳房部分切除術単独と、術後放射線療法の併用を比較しています。局所再発率(29.2%vs10.0%)、15年死亡率(31.2%vs26.1%)といずれにおいても術後放射線を行ったほうが有意に良好でした。
では、なぜ、今、APBI(Accerated Partial Breast Irradiation)が行われているのでしょうか。現在の標準治療となっている全乳房照射と比べてAPBIの利点は大きく3つあります。
- 照射期間が4−5日と短期であるため通院期間が短くて済む
- 最もRiskの高い切除範囲周辺に集中して照射できる
- 照射期間が短期のため、術後化学療法を遅らす必要がない
- 皮膚、肺、心臓、正常乳腺組織などに照射しないため、合併症を減らすことが可能である
- 10年局所コントロールが同等である
- 美容、QOLが優れている ということです。
APBIの適応は
- 小さい腫瘍(3cm以下)
- 完全切除がされている(断端陰性)
- 予後因子良好が望める症例
Brachytherapyの方法としては、Multi-catheter Interstitial、External Beam APBI、AccuBoostや術中照射などがありますが、切除腔へカテーテルを挿入し、内側から照射を行う、MammoSite Ballonなどがあります。
さらにElectronic brachytherapyであるXOFT、Pd-103 seeds、Hybrid Breast BrachytherapyとしてのSAVITM、ClearPathTM、ConturaTMBalloon などが開発されております。いずれも、切除断端から1?2cmを照射範囲としております。Mammositeが早くから臨床に用いられておりますが、 FDAによる試験で、43症例を対象にした39カ月フォローで、皮膚から6mm以下と以上で美容に有意に差があるということが報告されています。
これらの新しいモダリティは、それぞれの短所長所を知り適応を考えることにより、患者のより良い美容、QOLが保たれる可能性があります。今後、更なる長期成績が待たれますが、現在の術後照射に近い将来置き換わるでしょう。
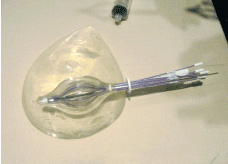
APBIの模型
Practical Oncoplastic Breast Surgery
Pat Whitworth, MD,Director, Nashville Breast Center,Clinical Associate Professor of Surgery, Vanderbilt University,Nashville, TN
患者の美容、Quality of Life(QOL)を高める手術をすることが必要です。そのためには外科医自身が、手術のOptionがあることを知らなければなりません。乳房切除術では、米国では25%前後が再建術を施行しており、これは1999年から2003年でほぼ変化は認めません。今回は、乳頭直下の腫瘍への手術の切開方法、乳頭温存乳房切除術などの説明がありました。AnnSurg誌の2003年の報告では、936人の18か月のフォローアップで再発率は、乳房切除術8%に対し、乳房温存乳房切除術5%という報告でした。しかし、この研究は追跡期間が短いため、結論付けはできません。また、乳頭乳輪の変形や壊死といった合併症もあるため、適応、手技に注意して行う必要があります。いずれにせよ、一昔前の切除だけではなく、病状に最適な治療を行うのはもちろんのこと、QOLを考える手術が行われる時代であるということです。
Community-Oriented Research
Mark Gittleman, MD,Medical Director, Breast Care Specialists, P.C.,Allentown, PA
米国では、はるかに多くの臨床試験が行われています。よりスムーズに臨床試験に患者をリクルートするために、患者、医師、その他の医療従事者の両サイドからの視点で考えることが大事です。適切な知識、適した臨床試験があることを知っていること、信頼関係、保険、標準治療が最高の治療とは限らないということ、これらを、ひとつずつクリアして臨床試験に参加してゆく必要があります。
ワークショップの後、最新機械の展示があり、現在日本でも使用されている生検用の改良が進んだものや、術中照射、乳房部分照射の道具に実際に触れることができました。そこで、部分照射のワークショップのプレゼンターであった2人の医師と、個別に1時間ほど講義では聞くことのできない臨床現場での工夫、苦労を聞くことができたのが貴重な体験でした。また、EBMが強く主張される流れの中で、薬物療法と違い、患者の役には立つであろうがエビデンスを反映する試験を組みにくい新しい外科的手技、診断技術、治療方法などが開発、研究されているのも事実です。そのため、実際にLevel1のエビデンスを求めることだけが大事なのではないという激しい議論がおこなわれたのが、非常に印象的でありました。今回、診断や治療において、いずれも世界では著しい技術の進歩を遂げ、いち早く臨床へ取り入れているのを実感しました。米国は日本よりも、外科医と腫瘍内科医の分業が進んでいます。また、保険制度、患者の人種など非常に背景が異なりますが、国際社会の医療事情にこれ以上後れを取らないように、これらの先端技術をいち早く日本へ取り入れ、患者が恩恵を受けられるようにしなければならないと痛感させられました。この有意義な会に参加する機会を得ることができましたことを、聖路加国際病院ブレストセンター長中村先生、JCCNB久保誠子様を初め事務局の皆様に感謝します。